海關(guān) | 重點(diǎn)國家地區(qū)醫(yī)用防護(hù)服標(biāo)準(zhǔn)
發(fā)布時(shí)間: 瀏覽次數(shù):5143
據(jù)海關(guān)總署2020年第53號公告,自4月10日起,,對11類,、19種海關(guān)商品編號項(xiàng)下的醫(yī)療物資實(shí)施出口商品檢驗(yàn)。海關(guān)實(shí)驗(yàn)室對出口醫(yī)療物資的檢測,,將按照以下標(biāo)準(zhǔn)進(jìn)行:進(jìn)口國(地區(qū))有質(zhì)量安全標(biāo)準(zhǔn)要求的,,依據(jù)進(jìn)口國(地區(qū))質(zhì)量安全標(biāo)準(zhǔn)進(jìn)行檢測;進(jìn)口國(地區(qū))無質(zhì)量安全標(biāo)準(zhǔn)要求的,,按照我國質(zhì)量安全標(biāo)準(zhǔn)進(jìn)行檢測,。
來源 | 海關(guān)發(fā)布
中國醫(yī)用防護(hù)服執(zhí)行國家標(biāo)準(zhǔn)GB 19082-2009《醫(yī)用一次性防護(hù)服技術(shù)要求》,該標(biāo)準(zhǔn)為強(qiáng)制性,,針對醫(yī)用一次性非織造防護(hù)服,,沒有對可重復(fù)使用的防護(hù)服作出規(guī)定。
美國的醫(yī)用防護(hù)服標(biāo)準(zhǔn)是由NFPA(美國車家防火協(xié)會)制定的NFPA1999,,適用于醫(yī)療急救時(shí)美國醫(yī)療器具開發(fā)協(xié)會組織制定的AAMIPB-70,,適用于評價(jià)衛(wèi)生用防護(hù)服裝的阻隔性能。
歐盟頒布了EN14126-2003防護(hù)服防病毒防護(hù)服的性能要求和試驗(yàn)方法,該標(biāo)準(zhǔn)主要關(guān)注點(diǎn)為防護(hù)服的耐血液,、體液和病毒的穿透性,。
中國《產(chǎn)品認(rèn)證》
國內(nèi)基于風(fēng)險(xiǎn)通常把醫(yī)療器械分成三類:第一,風(fēng)險(xiǎn)低的和基本沒有風(fēng)險(xiǎn)的屬于一類,,在地市局藥品監(jiān)管部門機(jī)構(gòu)備案,。第二,中等風(fēng)險(xiǎn)的醫(yī)療器械由省一級藥品監(jiān)管部門注冊審批,。第三,,高風(fēng)險(xiǎn)的醫(yī)療器械屬于三類,由國家局直接負(fù)責(zé)組織審批,。
美國《產(chǎn)品認(rèn)證》
美國食品與藥物管理局(FDA)根據(jù)風(fēng)險(xiǎn)等級將醫(yī)療器械產(chǎn)品分為三個(gè)等級進(jìn)行管理:一級指普通產(chǎn)品,,二級指通過特殊控制來保證其安全性和有效性的產(chǎn)品,三級指一般用來支持人體生命,,防止人體健康受損,,具有治病、致殘的潛在不合理風(fēng)險(xiǎn)的產(chǎn)品,。
美國醫(yī)用防護(hù)服可分為非手術(shù)防護(hù)服和手術(shù)用防護(hù)服兩類,。非手術(shù)防護(hù)服屬于I類醫(yī)療器械,免于上市前登記,,直接進(jìn)行機(jī)構(gòu)注冊,。而手術(shù)用防護(hù)服屬于II類醫(yī)療器械,需要進(jìn)行上市前登記,,即需要申請FDA 510K,。
II類產(chǎn)品上市前要通告,基本流程如下:
(1)產(chǎn)品測試(性能測試,、化學(xué)測試)
(2)準(zhǔn)備510K文件
(3)提交FDA評審
(4)FDA發(fā)510K批準(zhǔn)
(5)完成工廠注冊和機(jī)器列名
(6)產(chǎn)品出口
歐盟《產(chǎn)品認(rèn)證》
歐盟經(jīng)濟(jì)區(qū)市場涉及到安全,、衛(wèi)生、環(huán)境保護(hù)和消費(fèi)者保護(hù)的商品(如電子,、機(jī)械,、醫(yī)療器械、玩具,、個(gè)人防護(hù)設(shè)備,、通訊,、承壓設(shè)備等)已經(jīng)被強(qiáng)制性地列入“必須攜帶CE標(biāo)記,,否則不準(zhǔn)進(jìn)入歐盟市場流通”之列。
防護(hù)服屬于個(gè)人防護(hù)用品,,英文是Personal Protective Equipment,,簡稱PPE,歐盟的個(gè)人防護(hù)用品安全指令是89/686/EEC。根據(jù)PPE指令的規(guī)定,,按照PPE產(chǎn)品設(shè)計(jì)的復(fù)雜程度和防護(hù)級別將PPE產(chǎn)品分為三個(gè)類別,。在歐洲市場銷售的個(gè)人防護(hù)用品,必須符合適用的安全要求和標(biāo)準(zhǔn),。
獲得CE認(rèn)證需要以下程序(1)申請和提交型號
(2)提交供應(yīng)商證書和測試報(bào)告
(3)評估和認(rèn)證
(4)PPE型式證書
(5)符合性聲明
標(biāo)準(zhǔn)指標(biāo)對比分析
醫(yī)用防護(hù)服的“防護(hù)性能”是最為重要的性能要求,,主要包括液體阻隔、微生物阻隔和對顆粒物質(zhì)的阻隔等方面,。我國2003年首次頒布了《醫(yī)用一次性防護(hù)服技術(shù)要求》國家強(qiáng)制標(biāo)準(zhǔn),,并于2009年進(jìn)行了修訂,GB19082-2009《醫(yī)用一次性防護(hù)服技術(shù)要求》中規(guī)定的性能指標(biāo)相對較豐富,。目前國際上較通用的醫(yī)用防護(hù)服標(biāo)準(zhǔn)是美國美國國家職業(yè)安全衛(wèi)生研究所(NIOSH)標(biāo)準(zhǔn)和歐盟的EN標(biāo)準(zhǔn),。下面就中美歐醫(yī)用防護(hù)服標(biāo)準(zhǔn)中的防護(hù)性能進(jìn)行簡單比對。
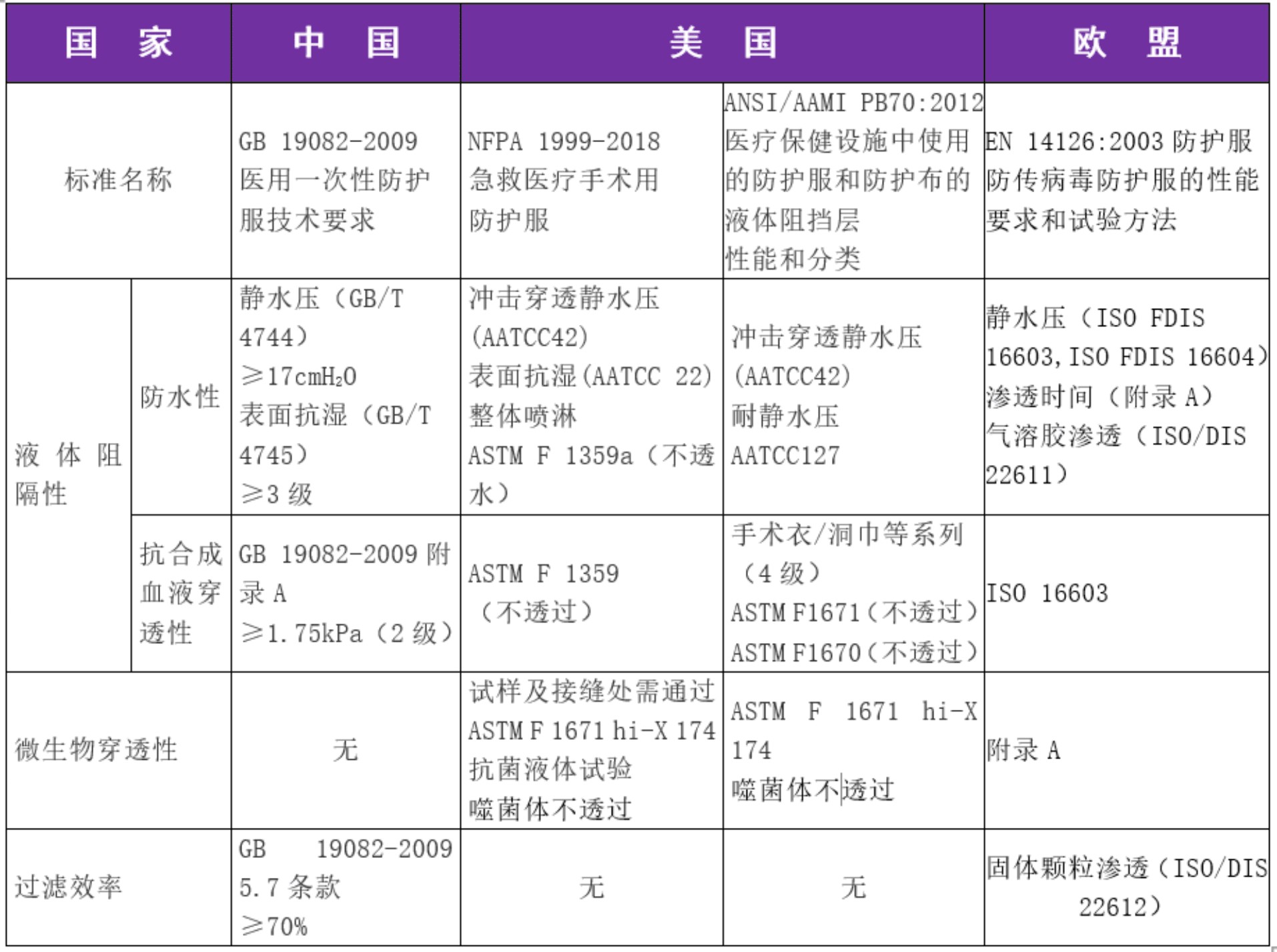
指標(biāo)分析
(1)國際上基本采用一次性非織造(無紡布)材料制成醫(yī)用防護(hù)服,,各國家對于防護(hù)服指標(biāo)考慮的側(cè)重點(diǎn),、產(chǎn)品性能要求、測試方法等存在一定的差異,,因測試方法不同,,關(guān)鍵項(xiàng)目指標(biāo)要求不可簡單根據(jù)數(shù)據(jù)對比。
(2)GB19082-2009《醫(yī)用一次性防護(hù)服技術(shù)要求》中,,關(guān)鍵指標(biāo)過濾效率是其他國家標(biāo)準(zhǔn)中未提及的,。但對某些關(guān)鍵指標(biāo)如“微生物穿透、抗污染物穿透等測試項(xiàng)目未涉及,,美國和歐盟標(biāo)準(zhǔn)均有不得透過的要求,。
(3)除關(guān)鍵指標(biāo)要求,在使用過程中的物理安全方面,,NFPA 1999除去對急救醫(yī)用防護(hù)服的斷裂強(qiáng)力要求之外,,還對其撕破、接縫,、項(xiàng)破,、刺破等強(qiáng)力有要求,并且對急救醫(yī)用防護(hù)服的整體熱舒適性也做出要求,。GB 19082測試時(shí)只考慮了防護(hù)服和手術(shù)衣關(guān)鍵部位材料的斷裂強(qiáng)力,,對撕破、頂破等未做要求,,在使用中存在一定的風(fēng)險(xiǎn),。
(4)在服用舒適度相關(guān)要求方面,中美歐標(biāo)準(zhǔn)側(cè)重點(diǎn)各有不同,,中國標(biāo)準(zhǔn)對透濕性有要求,,美國標(biāo)準(zhǔn)則關(guān)注保暖性能要求。
(5)美國防護(hù)服標(biāo)準(zhǔn)ANSI/AAMI PB 70 :12標(biāo)準(zhǔn)將防護(hù)服的隔離能力分為4個(gè)等級。其中,,規(guī)定防護(hù)等級最的產(chǎn)品需通過ASTM F1670(合成液穿透)與ASTM F1671(病毒穿透)兩項(xiàng)關(guān)鍵測試標(biāo)準(zhǔn),。而需至少通過ASTM F1670測試,才符合中國國標(biāo)醫(yī)用防護(hù)服的最低標(biāo)準(zhǔn),。
(6)歐標(biāo)防護(hù)服由兩個(gè)子標(biāo)準(zhǔn)體系組成,,防感染的EN14126標(biāo)準(zhǔn)和抗氣體、液體,、固體顆粒滲透的TYPE子標(biāo)準(zhǔn),。按照針對防護(hù)的物體不同,歐標(biāo)防護(hù)服分為6類TYPE:TYPE 1及TYPE 2類針對氣體級防護(hù),、TYPE 3/4/6針對液體防護(hù),、TYPE 5針對固體及氣溶膠顆粒防護(hù)及衣服的抗撕扯強(qiáng)度。歐標(biāo)防護(hù)服的抗合成血液滲透測試參照標(biāo)ISO 16603,。該標(biāo)準(zhǔn)將防護(hù)服的抗合成液滲透測試等級分為6級,,6級最高。ISO 16603的第2級(CLASS 2)和中國國標(biāo)的級致,,均為1.75kPa,。歐標(biāo)防護(hù)服需有EN14126字樣,并最少達(dá)到TYPE4,,才符合我國國標(biāo),。